有關「疑致癌降血壓藥228萬粒下架回收」事件:
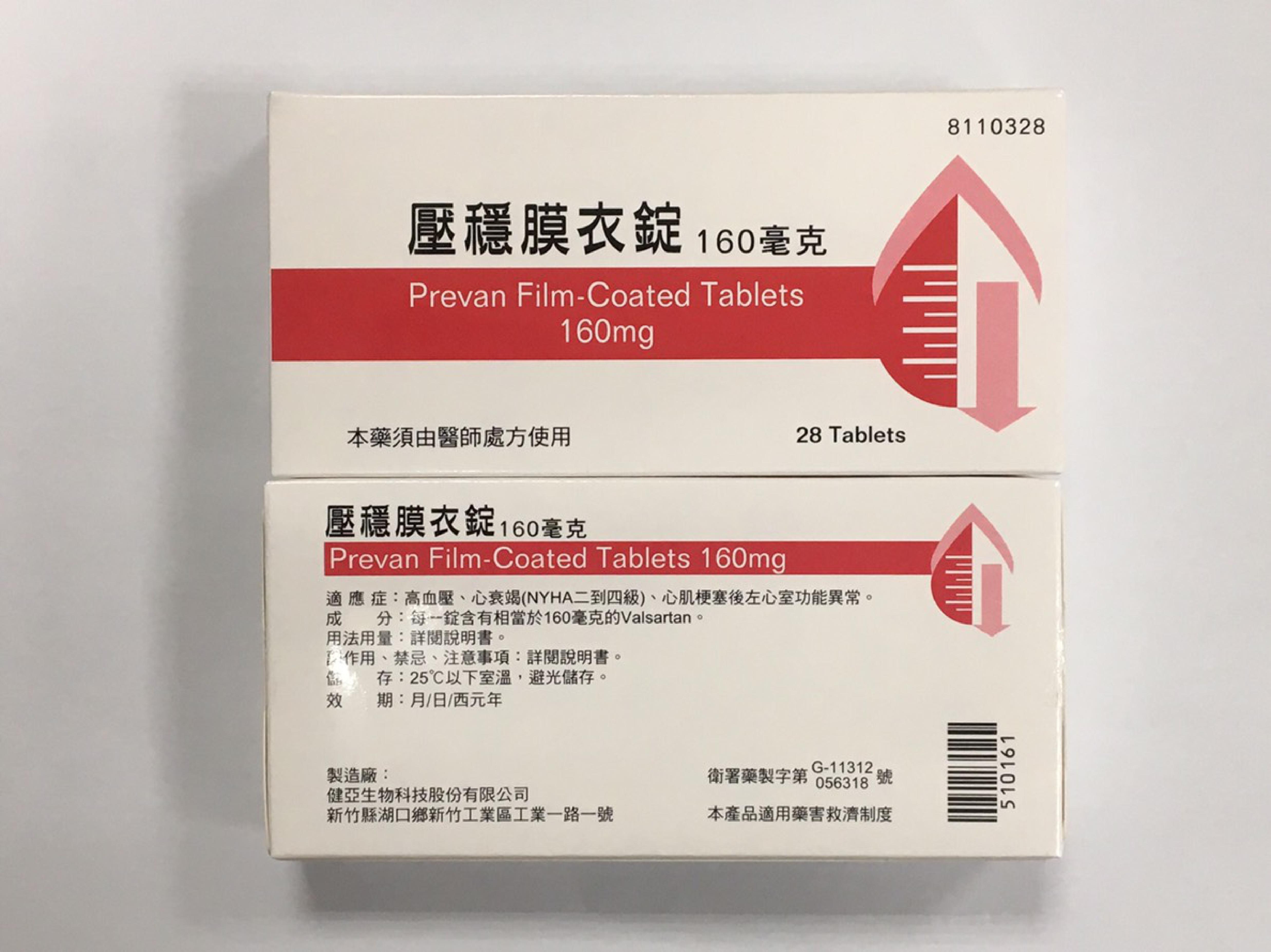
......「壓穩膜衣錠」80毫克及160毫克產品使用的印度降血壓原料藥,被驗出N-亞硝基二乙胺(NDEA)不純物,該成分具動物致癌性,總共25批、228萬顆,將全數下架回收......問題藥品是由印度藥廠(Mylan Laboratories Limited)所生產的纈沙坦(valsartan)降血壓原料藥,遭歐盟驗出含有致癌疑慮的NDEA,啟動全球下架行動......
說明如下:
- 事件說明:衛生福利部食品藥物管理署抽驗發現,印度Mylan Laboratories Limited所生產之valsartan原料藥,有部分批號檢出動物致癌性成分「N-亞硝基二乙胺」(NDEA),經查我國健亞生物科技股份有限公司有輸入使用,該公司並已決定自107年11月19日起,全面回收使用該原料藥來源之製劑藥品,包括:
- 「壓穩膜衣錠80毫克(衛署藥製字第056320號)」(效期111年7月30日前)藥品。
- 「壓穩膜衣錠160毫克(衛署藥製字第056318號)」(效期108年11月4日前)藥品。

- 已請業者即時通知醫療機構及藥局立即下架停止供應,並請衛生局督導下架回收:食藥署並於同日請業者即時通知醫療機構及藥局立即下架停止供應,於1個月內(107年12月19日前)完成回收,請衛生局督導下架回收事宜。
- 提醒正在使用該藥品的患者:該藥品主要用於高血壓等需定期服藥控制之疾病,故不建議任意停藥,應儘速回診時,與醫師討論,處方其他適當藥品。
- 食藥署將持續主動抽驗及監測藥物安全:
- 為確保民眾用藥安全,食藥署已於107年11月12日公告NDEA及NDMA之檢驗方法,並持續主動抽驗sartan類藥品之原料藥及製劑,倘發現有異常情形,則立即採取風險管控措施。
- 為確保藥物安全與醫療效能,食藥署已建置藥物安全監測機制,即時監視國內、外藥物安全訊息,除設有藥物不良反應通報系統及藥物不良品通報中心之外,並對於藥物之安全性與療效亦隨時進行再評估,
詳細新聞稿說明,請參考:https://www.mohw.gov.tw/cp-16-45303-1.html
延伸閱讀:
- 全國藥物不良品通報系統(發現藥物不良品時,可用此系統通報)
- 全國藥物不良反應通報系統(醫療人員或病患疑似因使用(服用)藥品導致不良反應,可用此系統通報)
- 藥物不良品通報專線:02-6625-1166分機6401
- 藥物不良反應通報專線:02-2396-0100
